В данной работе были оценены характеристики прототипа ОФЭКТ-системы на основе микросхемы считывания Timepix с коллиматором на основе кодирующей апертуры типа MURA. Установка имеет небольшое поле зрения и может использоваться в доклинических исследованиях лекарственных препаратов на мелких лабораторных животных. Несмотря на множество существующих протоколов испытаний, разработанных и описанных в соответствующих документах национальных органов стандартизации и рекомендациях МАГАТЭ, они не подходят для микротомографических систем на основе полупроводниковых пиксельных детекторов из-за различной технологии детекторов, высокого пространственного разрешения и малой области интереса. Для измерения их характеристик были разработаны специальные фантомы с небольшой «горячей областью».
Такие параметры микро-ОФЭКТ системы, как пространственное разрешение, контрастность, линейность, однородность и чувствительность системы были исследованы с использованием источника 99mTc. Описаны процедуры калибровки детектора и предварительной обработка данных.
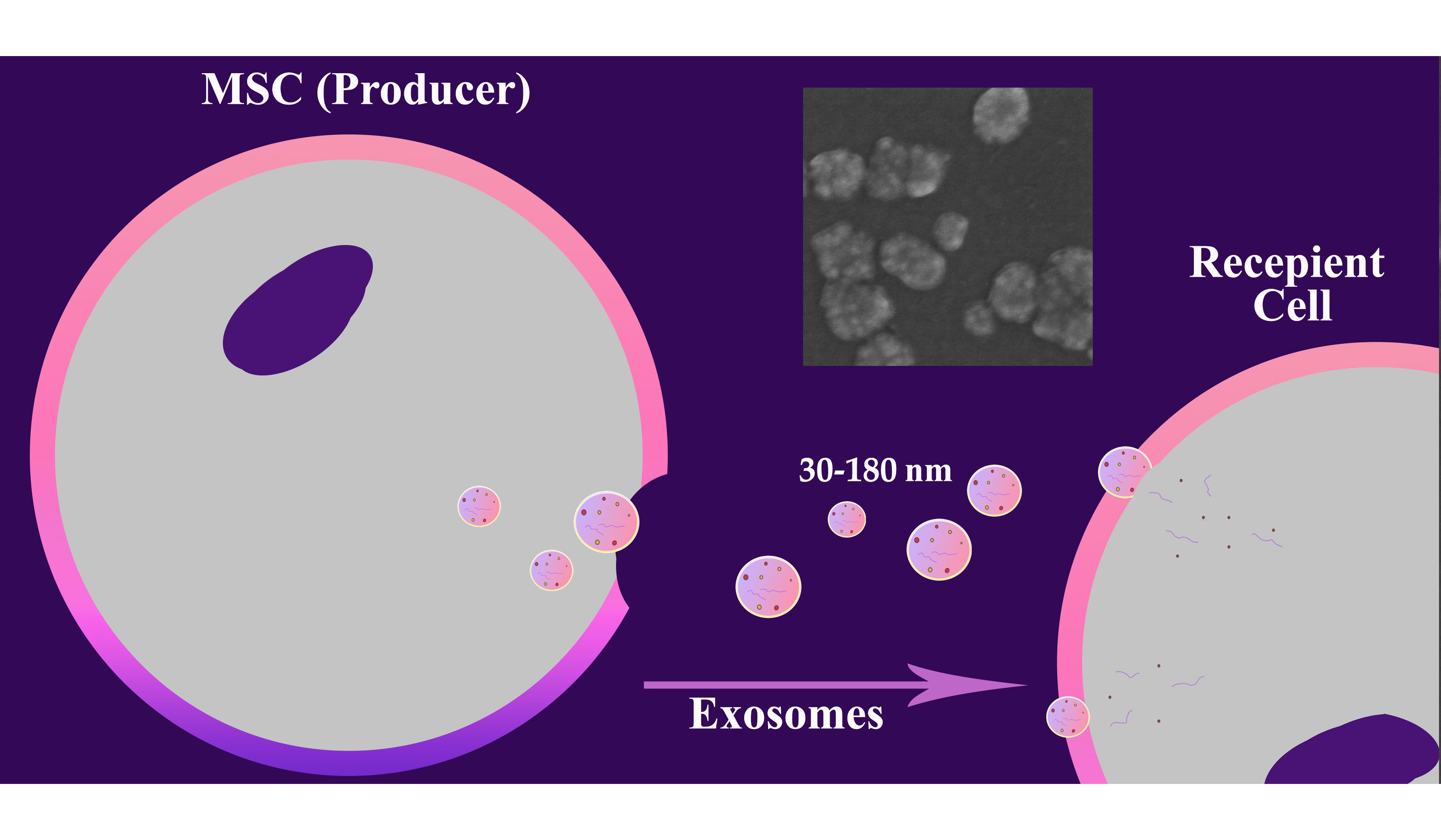
В исследовании представлен сравнительный анализ различных компонентов кондиционированных сред (КС), полученных с помощью мезенхимальных стволовых клеток (МСК), культивированных с использованием сыворотки и без сыворотки, который выявил существенные различия в их составе и потенциальном клиническом применении. Кондиционированная среда, содержащая сыворотку, демонстрирует значительно более высокие уровени общего белка, невезикулярной РНК, экзосом и наночастиц по сравнению с бессывороточными кондиционированными средами, что отражает вклад как секретома МСК, так и остаточных компонентов фетальной бычьей сыворотки. Фракционирование на основе ультрафильтрации (0,2 мкм-50 кДа) позволяет выделить фракцию, обогащенную экзосомами и белками, сохраняя функционально значимые компоненты секретома МСК. Эта стратегия эффективно захватывает везикулы и белки среднего размера, исключая при этом более крупные или мелкие биомолекулы, что повышает эффективность их использования для целевого анализа. Представленные данные подчеркивают необходимость подбора КС с учетом целей эксперимента и предоставляют информацию для выбора оптимальной стратегии получения секретома МСК, обеспечивающей баланс между конечным результатом, чистотой и нормативными требованиями в области исследований и терапии МСК.
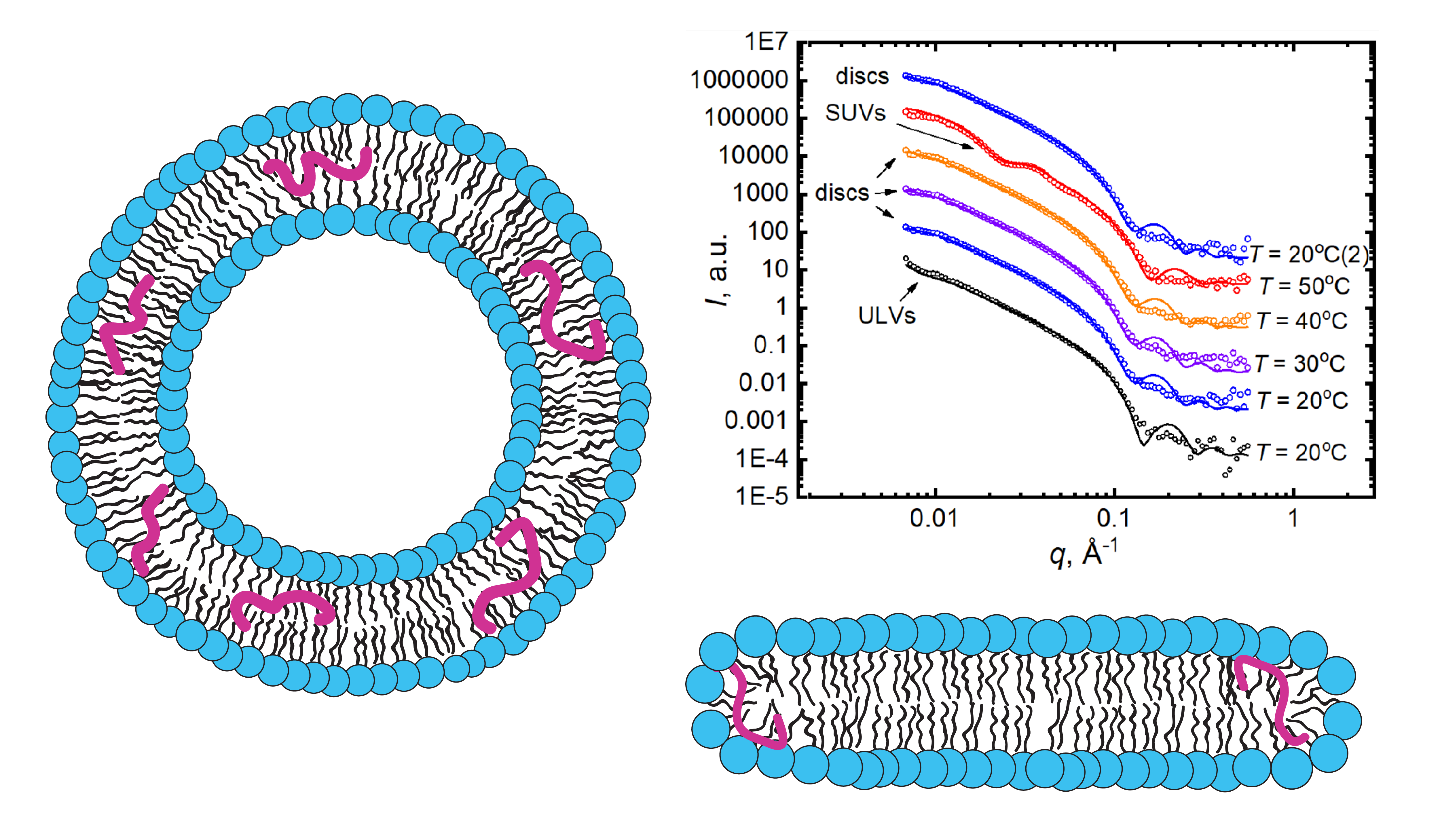
Липид–белковые взаимодействия играют центральную роль в поддержании структурного и функционального баланса биологических мембран, влияя на широкий спектр клеточных процессов. Однако данные взаимодействия становятся патологическими при нейродегенеративных заболеваниях, таких как болезни Альцгеймера, Паркинсона и Хантингтона. При этих нарушениях неправильное сворачивание и агрегация таких белков, как бета-амилоид (Aβ), альфа-синуклеин (α-syn) и мутантный хантингтин (mHtt), разрушают липидный бислой, повреждая целостность мембраны, ее текучесть и передачу сигналов. В этом обзоре мы исследуем решающую роль липид–белковых взаимодействий при нейродегенеративных заболеваниях, подчеркивая, что неправильное сворачивание белков приводит к образованию токсичных агрегатов, которые встраиваются в мембраны, вызывая нейротоксические явления. Передовые спектроскопические методы сыграли важную роль в изучении этих молекулярных взаимодействий. Световые методы, включая Фёрстеровский перенос энергии (FRET), круговой дихроизм (CD) и рамановскую спектроскопию, позволяют в режиме реального времени получить представление об агрегации белков и динамике липидных мембран. Методы, основанные на нейтронах, такие как нейтронная рефлектометрия и малоугловое рассеяние нейтронов (SANS), дополняют и обогащают анализ липид-белковых взаимодействий, особенно в контексте нейродегенеративной агрегации.
Кроме того, в обзоре подчеркивается важность липидных микродоменов, в частности богатых холестерином липидных рафтов, которые способствуют агрегации белков, влияющих на прогрессирование заболевания. Также обсуждаются терапевтические стратегии в отношении липид–белковых взаимодействий с акцентом на то, как спектроскопические исследования способствуют разработке лекарств, стабилизирующих целостность мембран или предотвращающих токсическую агрегацию. Наконец, интеграция спектроскопии с вычислительными моделями, такими как молекулярная динамика (MD), представляется как многообещающий подход для выявления особенностей сложной динамики липид–белковых взаимодействий, обеспечивая более полную картину механизмов развития заболевания.
Предполагается, что бета-амилоидный пептид (Аβ-пептид) играет центральную роль в возникновении болезни Альцгеймера (БА). Эта патология связана с быстрым накоплением нейротоксичных амилоидных агрегатов в тканях мозга, хотя основы прогрессирования заболевания остаются неразрешенными. Отмечено, что доклиническая стадия БА может играть решающую роль в дальнейшем необратимом развитии болезни. В частности, взаимодействия между липидными мембранами и молекулами Аβ-пептида, встроенного в мембрану в относительно низких концентрациях, должны находиться под пристальным вниманием исследователей. В этом обзоре мы обсуждаем недавние работы, посвященные изучению липид-пептидных взаимодействий, с акцентом на вызванную пептидом Аβ(25-35) реорганизацию липидных мембран в условиях, имитирующих доклиническую стадию БА. Предполагается, что наблюдаемые взаимодействия важны для понимания механизмов деструктивного воздействия Аβ-пептида на липидные мембраны и последующего возникновения заболевания. Методы прикладной ядерной физики оказались чрезвычайно актуальными в таких исследованиях. Методы рассеяния предоставили инструментальную информацию на уровне надмолекулярных агрегатов, в то время как спектроскопия позволила получить информацию на молекулярном уровне. Наконец, компьютерное моделирование методом молекулярной динамики предоставило детали, недостижимые экспериментальными подходами, хотя в ключевой роли последних невозможно усомниться. Таким образом, последние достижения в исследованиях доказывают, что эти взаимодополняющие подходы являются наиболее подходящими для решения сложных проблем во взаимодействиях биомембран.